Composizione tipica dell’aria indoor in condizioni std – Le molecole di radon in mezzo alle altre.
1- Composizione dell’aria indoor – i principali gas
L’aria secca standard
La composizione molecolare dell’aria di un usuale ambiente indoor è costituita innanzitutto da gas che formano in modo pressoché costante l’atmosfera terrestre, per effetto dei cicli dell’ossigeno e dell’azoto, e da altri che invece sono fortemente variabili nel tempo e nello spazio. Questi ultimi sono, oltre al vapore acqueo: l’anidride carbonica, il metano, gli inquinanti specifici urbani o domestici indoor ed anche i nuclidi radioattivi gassosi che nascono dalle catene dell’uranio 238 e 235 e dal torio 232, gli isotopi del radon.
Di tutti esaminiamo qui solamente i gas e il vapor d’acqua; non teniamo conto del particolato solido o liquido (amianto, pulviscolo, polveri, fibre, fumi, aerosol etc.) e degli altri vapori.
I dati numerici riportati sono tratti dalla corrente più affidabile letteratura scientifica, ma non pretendono ovviamente di rappresentare la situazione in modo esatto.
L’aria secca in condizioni standard (1 [atm] e 0 [°C]) ha peso molare 28,96 [g] e densità 1,293 [kg/m3]; è costituita principalmente da tre gas, nella seguente percentuale volumetrica:
azoto (N2 – peso mol 28,01 g – densità 1,251 kg/m3) 78,084 %
ossigeno (O2 – peso mol 32 g – densità 1,429 kg/m3) 20,946 %
argon (Ar – peso mol 39,95 g – densità 1,783 kg/m3) 0,934 %
(Consideriamo questi tre gas come formati esclusivamente dai nuclidi N-14, O-16 e Ar-40 trascurando gli altri loro isotopi).
I principali gas
Inoltre vi sono presenti, in quantità molto inferiori, altri gas di cui riportiamo la concentrazione volumetrica tipica basale in ppm, in condizioni standard (l’1% corrisponde a 10 000 ppm).
Essi sono (trascurando quelli con concentrazione < 0,01 ppm):
neon (Ne – peso mol 20,18 g – densità 0,90 kg/m3) 18,18 ppm
elio (He – peso mol 4,003 g – densità 0,1785 kg/m3) 5,24 ppm
monossido di azoto (NO – peso mol 30,01 g – densità 1,34 kg/m3) 5,00 ppm
kripton (Kr – peso mol 83,80 g – densità 3,68 kg/m3) 1,14 ppm
metano (CH4 – peso mol 16,04 g – densità 0,7167 kg/m3) 1,70 ppm
idrogeno (H2 – peso mol 2,02 g – densità 0,0899 kg/m3) 0,55 ppm
ossido di diazoto (N2O – peso mol 44,01g – densità 1,98 Kg/m3) 0,50 ppm
xeno (Xe – peso mol 131,30 g – densità 5,85 kg/m3) 0,087 ppm
ossido di carbonio (CO – peso mol 28,01 g – densità 1,2501 kg/m3) 0,04 – 0,20 ppm
biossido di zolfo (SO2 – peso mol 64,06 g – densità 2,9268 kg/m3) 0,01 ppm
ozono (O3 – peso mol 48 g – 2,144 kg/m3) 0 – 0,02 ppm
A parte i gas nobili, gli altri possono essere localmente presenti in percentuali sensibilmente superiori per cause antropiche.
Possono poi essere presenti o no, nel nostro ambiente indoor, altri gas inquinanti di svariata tipologia: i clorofluorocarburi (CFC), la formaldeide, i composti organici volatili (VOC), gli idrocarburi policiclici aromatici (IPA) ed altri. Nel nostro studio però li ipotizziamo assenti in quanto non tipici basali.
2 – Composizione dell’aria indoor – l’anidride carbonica e il vapor d’acqua
Anidride carbonica
Un discorso a parte va fatto per l’anidride carbonica (CO2 – peso molare 44 [g] – densità 1,9768 [kg/m3] in condizioni std), la cui concentrazione in aria è strettamente connessa ai biosistemi terrestri e anche alle attività antropiche passate e presenti.
I valori della CO2 nell’atmosfera, circa 280 ppm nell’anno 1900, hanno raggiunto nel 2020 i 412,5 ppm, secondo il “31° State of the Climate – 2020” del NOAA (USA), che è il più alto valore degli ultimi 800 000 anni. Sempre secondo il NOAA nel giugno 2023 il valore è stato aggiornato a 424,0 ppm. Questo gas può ovviamente anche trovarsi, in particolari ambienti, in concentrazioni molto superiori alla media.
Vapor d’acqua
In atmosfera è presente poi una notevole quantità di acqua, sotto forma di vapore (peso molare 18,016 [g]), di cui non si può non tener conto. La sua concentrazione locale dipende dalla temperatura e dalla pressione dell’aria; la si misura in grammi per chilogrammo di aria secca o per metro cubo oppure con la sua percentuale volumetrica, che rientra nell’intervallo 0 – 7%, e la si chiama umidità assoluta H.
Per ogni temperatura e pressione la concentrazione della quantità di vapore in aria può arrivare fino ad un valore massimo al di sopra del quale si condensa naturalmente. Siamo allora in condizioni di saturazione.
Generalmente, soprattutto in ambienti indoor, la quantità di vapore presente in aria è inferiore al massimo possibile per quelle condizioni di temperatura e pressione, e per questo si utilizza una grandezza detta umidità relativa HR che ne indica la percentuale rispetto all’umidità assoluta H. In condizioni di saturazione il coefficiente di umidità relativa HR è pari al 100% altrimenti è < 100%.
Usualmente in un ambiente indoor l’umidità relativa HR va da 30% al 70%.
Con la diminuzione della temperatura la quantità di vapore massima possibile in aria (umidità assoluta H), scende fino ad annullarsi (a circa -40 [°C]).
Ipotizziamo che il nostro ambiente sia in condizioni standard, a 0 [°C] e alla pressione di 1 [atm], con umidità relativa del 50% . Allora, dal diagramma psicrometrico, si legge che il contenuto di vapore acqueo è di poco meno di 2 grammi per chilogrammo di aria secca. Dato che la densità dell’aria secca è, in quelle condizioni std, di 1,293 [kg/m3], si calcola che il contenuto di acqua è di 1,547 [g/m3].
Sapendo che il peso di una mole di acqua è 18,016 grammi, tale contenuto corrisponde a 0,08587 moli per metro cubo.
3 – Il radon all’interno della composizione dell’aria indoor – situazione della percentuale molare
La percentuale molare
Moltiplicando le concentrazioni volumetriche sopra riportate per la densità e dividendo per il peso molare si ottengono le concentrazioni espresse in [moli/m3].
Ricordando poi che il numero di molecole di ciascun gas presenti in una mole è pari al numero di Avogadro N = 6,022 E+23, si ricava la seguente tabella che illustra meglio la composizione dell’aria indoor:
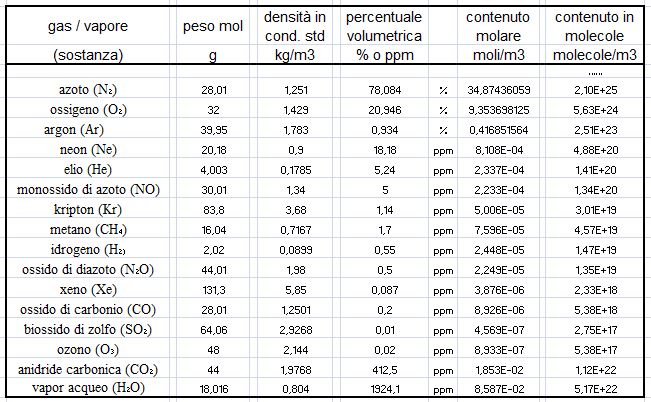
Dove, ricordiamo, il vapor acqueo è in condizioni std con una percentuale di umidità relativa del 50%.
Il radon
Negli spazi indoor possono accumularsi anche i prodotti gassosi delle catene di decadimento primordiali che partono dai radionuclidi naturali U-238, Th-232 e U-235. Essi sono il Radon (Rn-222), il Thoron (Rn-220) ed infine l’Actinon (Rn-219). Tutti e tre hanno densità 9,73 [kg/m3]. Non sono nella tabella precedente perché hanno concentrazioni inferiori a 0,01 ppm come vedremo adesso.
Se si ha, per esempio, nel nostro ambiente indoor come sopra definito, 100 [Bq/m3] di attività specifica di Rn-222, cosa non insolita, allora questo gas sarà presente in concentrazione di 1,8E-12 ppm, ovvero più esattamente saranno presenti 47’659’500 molecole monoatomiche di radon per metro cubo. Il discorso è valido in proporzione per altri valori di attività specifica.
Il Rn-222 si diffonde facilmente e anche uniformemente una volta che ha raggiunto l’ambiente indoor. Mentre la forte variabilità nel tempo della sua concentrazione è dovuta agli incostanti meccanismi di produzione e di sottrazione.
Se l’attività specifica di 100 [Bq/m3] fosse invece dovuta al Thoron, allora questo implicherebbe la presenza di soli 8’019 atomi di Rn-220 per metro cubo, corrispondente ad una concentrazione di circa 3E-16 ppm. La breve vita del Thoron (tempo di dimezzamento di 55,6 [sec]) unitamente alla sua conseguente bassissima concentrazione fanno sì che esso non riesca a raggiungere l’uniformità nella distribuzione spaziale. In effetti lo si trova solamente nelle vicinanze della sua sorgente Ra-224 e per questo non ne analizzeremo qui la concentrazione.
Per ragioni analoghe trascuriamo la presenza nell’ambiente indoor in esame del Actinon; infatti il suo brevissimo tempo di dimezzamento (3,5 [sec]) gli impedisce in pratica di raggiungere l’ambiente stesso prima della sua scomparsa.
4 – Il radon all’interno della composizione dell’aria indoor – la percentuale molecolare
Prendiamo infine in considerazione, per semplicità, la composizione di gas presenti in un solo centimetro cubo di aria di un ambiente indoor con una attività specifica ipotetica di 100 [Bq/m3] dovuta al Rn-222.
In questo piccolo volume troviamo, nelle condizioni sopradette, circa 48 molecole monoatomiche di Rn-222 insieme a un gran numero di molecole degli altri gas e di vapor d’acqua.
Per quantificare quanto detto torniamo ai valori della tabella precedente e per comodità introduciamo una unità di misura che chiamiamo Teram (mille miliardi di molecole, 1012 molecole).
La tabella seguente, partendo dalla precedente che illustrava la composizione dell’aria indoor, indica le concentrazioni (in Teram per centimetro cubo) di molecole monoatomiche o pluriatomiche di gas e di vapor d’acqua che circondano le solitarie 48 molecole monoatomiche di radon.
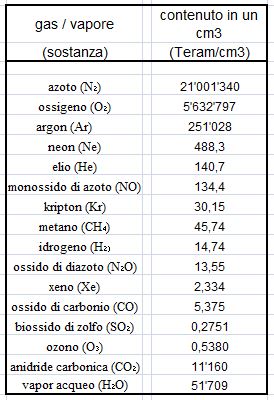
Per un totale di 26’948’762 Teram, che corrispondono a circa 2,7 E+19 molecole di gas e di vapore acqueo.
5 – Il radon all’interno della composizione dell’aria indoor – conclusioni
Le dimensioni atomiche
I raggi atomici degli elementi naturali vanno da 0,025 [nm] a quasi 0,3 [nm] (gas: idrogeno 0,025 [nm]; elio 0,03 [nm]; neon 0,04 [nm]; kripton 0,09 [nm]; azoto 0,065 [nm]; ossigeno 0,060 [nm]; xeno 0,11 [nm]; radon 0,12 [nm]. Solidi o liquidi: bismuto 0,16 [nm]; polonio 0,19 [nm]; piombo 0,18 [nm]; uranio 0,175 [nm]; cesio 0,26 [nm]; francio 0,27 [nm]; fermio 0,29 [nm]).
Le molecole di gas, mono o pluriatomiche, hanno dimensioni da <1 [nm] fino a 7 [nm].
La progenie del radon unattached, free o aggregata in clusters, ha dimensioni che vanno da <1 [nm] a 4 [nm] e sono particelle solide monoatomiche. Quella attached ha le dimensioni del particolato a cui aderisce, da 10 [nm] a crescere; per esempio le particelle di fumo vanno da 10 [nm] a 300 [nm] e gli aerosol vanno da 5 a 50’000 [nm].
Pertanto le molecole monoatomiche di radon sono circondate da molecole di gas di dimensioni simili e da altre particelle non gassose (compresa la progenie) più grandi o molto più grandi.
Le molecole di radon in mezzo alle altre
Rimanendo nell’ambito dei soli gas, le rare molecole di radon vedono intorno a sé fino a milioni di Teram di altri gas prima di scorgere un’altra molecola di radon.
Più esattamente, ad esempio, il rapporto tra il numero di molecole di azoto e quelle di radon è 0,44E+18. In altre parole circa mezzo miliardo di miliardi di molecole di azoto ogni molecola di radon.
Inoltre tutte le molecole di gas sono molto distanti tra loro.
Facciamo infatti un calcolo sommario. Se una molecola di gas ha dimensioni intorno a 1 [nm], essa ha un volume di 1E-21 [cm3].
Dato che in un centimetro cubo ci sono circa 2,7E+19 molecole di gas la sua percentuale di riempimento è 1E-21 x 2,7E+19 / 1 = 2,7 %.
Più del 97 % del nostro centimetro cubo è vuoto da molecole di gas.
In conclusione tutte le molecole di gas navigano come nel vuoto a grande distanza l’una dall’altra e quelle di radon sono distanti tra di loro infinite volte di più; infatti prima che una molecola di radon incontri ed eventualmente interagisca con un’altra uguale dovrà incontrare, ad esempio, mezzo miliardo di miliardi di molecole di azoto.
Revisionato agosto 2023